أرسل بواسطة: geologe في ديسمبر 15, 2006, 05:49:23 مساءاً

اللهم علما نافعا ..
وقلبا خاشعاً ..
وعملاً متقبلاً ...
جميعنا يعلم أن المعادن عبارة عن مواد طبيعية غير عضوية لها تركيب كيميائي محدد وشكل بلوري منتظم ..
و يمكننا التعرف على هذه المعادن بواسطة خواصها الطبيعية كاللون و المخدش و الانفصام والصلادة والبريق ومن خلال هذه الهواص نستطيع أن نفؤق بين المعادن المختلفة
فمثلاً معدن الكوارتز عرفناه بلونه الأبيض الحليبي وميزناه بصلابته التي تبلغ 7 درجات على مقياس موهو للصلابة ..
أيضاً معادن الميكا عرفنا منها معدن المسكوفايت بلونه الفاتح ومعدن البيوتيت بلونه الأسود وميزناهم بمستويات الانفصام الموازية للمحور B ..
لاحظ أننا قد نستخدم حواسنا لمعرفة المعادن بصفاتها الطبيعية فنستخدم اللمس لمعرفة الملمس الصابوني لمعدن التلك أو الشم لتمييز رائحة الكبريت المميزة لمعدن الفوسفات أو التذوق لمعرفة معدن الهاليت ..
وبذلك استخدمنا الصفات الطبيعية للمعادن في تعريفها والتفريق فيما بينها ..
إذن فالصفات الطبيعية ناجحة في عمليات تعريف المعادن لكنها غير كافية للتعرف على المعدن بدقة فاللون وحده لا يكفي للتفريق بين المعادن فقد يشترك أكثر من معدن في نفس اللون مثل معدني الكاسيت والكوارتز وحتى في الصلابة فمن الصعب جداً التفريق بين معدني الكوارتز والفلدسبار بواسطة الصلابة لكونهم متقاربين في درجتها ..
لذلك اهتم العلماء بدراسة الخواص البصرية للمعادن لتساعد أكثر في التعرف على المعادن بدقة أكبر ...
بالإضافة إلى ذلك لاحظنا أن المعادن كلها تظهر في أشكال منتظمة ومحددة وقد لاحظ ذلك كل اللذين قاموا بدراسة المعادن من القرن الثامن عشر وحتى الآن واستنتجوا بأنه لا يمكن أن يكون هذا الشكل الخارجي المنتظم للمعادن سوى انعكاس للتركيب الداخلي لهذا المعدن ..
فمثلاً لو كان لدينا معدن على شكل مكعب .. هذا الشكل المنتظم ما هو إلا انعكاس للانتظام في التركيب الداخلي لهذا المعدن وتطلق على هذا الشكل المنتظم اسم البلورة ..
ويمكننا تعريف البلورة بأنها شكل هندسي منتظم محدد بأسطح ملساء ويحتل جزءاً من الفراغ .. والبلورة عبارة عن عدد لانهائي من الذرات المرتبطة مع بعضها البعض وبشكل منتظم وتذكر أنه يمكننا قياس أقطار هذه الذرات بوحدة الأنجستروم حيث أن 1 ملم = 10000000 أنجستروم فلو تخيلنا وجود بلورة من معدن الهاليت NaCl فهذه البلورة تحتوي على عدد لانهائي من ذرات الـ Na و الـ Cl المرتبطة مع بعدها برابطة كيميائية والموزعة بشكل منتظم .. لذلك عندما قلنا أن البلورة تحتوي على أوجه ملساء فلم يكن وجود كلمة ملساء في التعرف مجازاً وإنما لها مدلولها الخاص الذي يدل على أن هذه الذرات مترتبة في صف واحد منتظم ...
ومنذ القرن الثامن عشر حتى عام 1912 م كان الناس يعرفون أن الشكل المنتظم للبلورة ماهو إلا انعكاس لانتظام المكونات الداخلية للبلورة إلا أنهم لم يعرفوا شكل هذا الانتظام حتى أتى عالم ألماني وقدم للعالم أول نموذج للتركيب الداخلي لبلور معدن الهاليت ( ملح الطعام ) وحصل عليها على جائزة نوبل حيث قام بتسليط أشعة اكس على بلورة الهاليت واستقبل الانعكاس على فيلم أبيض وأسود ورسم أول نموذج للتركيب الداخلي لبلورة الهاليت ( ملح الطعام ) ... يتبع
أرسل بواسطة: geologe في ديسمبر 15, 2006, 05:52:18 مساءاً

ذكرنا في الرد السابق أنه لا يمكن أن يكون الشكل المنتظم للبلورة إلا انعكاس لانتظام الترتيب الداخلي لهذه البلورة ..ومعنى ذلك أن ذرات العناصر التي تكون المعدن موزعة في الفراغ الهندسي بشكل منتظم
هذا التوزيع لذرات العناصر في الفراغ الهندسي لا يمكن أن يكون متطابق في جميع المعادن .. بمعنى آخر أن كل معدن في هذا الكون له ترتيب ذري داخلي يميزه عن بقية المعادن لذلك وجب علينا دراسة هذا الترتيب حتى نتمكن من التعرف على المعدن بدقة ..
قبل أن ننطلق لدراسة الترتيب الذري الداخلي للمعادن يجب علينا أن نعرف ما هو المعدن ..
يمكننا تعريف المعدن بأنه مادة طبيعية صلبة غير عضوية ومتجانسة لها تركيب كيميائي معين وترتيب ذري داخلي منتظم ..
لكن مالذي يحكم انتظام ذرات العناصر في الفراغ الهندسي .. ؟
هذا ما سنعرفه في الرد القادم بمشيئة الله تعالى
أرسل بواسطة: geologe في ديسمبر 15, 2006, 06:00:08 مساءاً
وقد طرحنا تساؤلاً بسيطاً فقلنا :
مالذي يحكم انتظام الذرات في الفراغ الهندسي ..؟
لو أعطيتك مجموعة من الكرات وطلبت منك توزيعها في الفراغ الهندسي في بعد واحد وبشكل منتظم .. فسترتبها وبكل تأكيد كما في الشكل التالي

لاحظ أن المسافة بين كل كرة والأخرى متطابقة ولنعطي هذه المسافة القيمة a ، وتذكر بأن الانتظام في الترتيب الداخلي للذرات يعني أن تكون الظروف المحيطة يالذرات المتشابهة متطابقة . لاحظ الشكل التالي

قد يبدو لك هذا الترتيب عشوائياً للوهلة الأولى إلى أنه في الواقع ليس كذلك فلو دققت النظر النقاط الخضراء فستجد أن كل نقطة خضراء تحيط بها أربع نقاط اثنين منهما باللون الأحمر والأخرى باللون الأزرق ( الرسم غير دقيق لكن الهدف منه إعطائك فكرة عن كيفية انتظام هذه النقاط التي تمثل الذرات في الفراغ )
نعود للعوامل التي تحكم انتظام البلورات في الفراغ الهندسي .. والآن سأعطيك مجموع جديدة من الكرات وأطلب منك ترتيبها في الفراغ الهندسي بشكل منتظم وفي بعدين ، بكل تأكيد سترتبها كما في الشكل التالي :

وستخبرني بأن هذا الترتيب منتظم ويحكمه المسافات a و b بكونها متساوية ..إذن ما رأيك لو وزعتها كما في الشكل التالي ..

أليس هذا الترتيب ترتيباً منتظماً ..؟
إذن ما يحكم توزيع الذرات في الفراغ الهندسي في بعدين وبشكل منتظم المسافة a و b والزاوية بينهما ولتكن α ..
ولترتيب الكرات بشكل منتظم في الأبعاد الثلاث فإننا سنرتبها كما في الشكل التالي ..

إذن ينتج من انتظام الكرات في الأبعاد الثلاثة أشكال متعددة الأوجه Polyhedral ويحكم انتظامها المسافة a و b والزاوية بينهما α بالإضافة إلى المسافة الجديدة c والزاوية β بين a و c والزاوية γ بين b و c ...
من ذلك نعلم أن ما يحكم توزيع ذرات العناصر في الفراغ الهندسي بشكل منتظم : أطوال الأبعاد a و b و c والزوايا بينهما α و β و γ ..
ومن خلالها تم تقسيم جميع الأشكال البلورية إلى سبعة أنظمة هي :
1- ثلاثي الميل Triclinic
2- أحادي الميل Monoclinic
3- المعيني القائم Orthorhombic
4- الرباعي Tetragonal
5- الثلاثي Trigonal
6- السداسي Hexagonal
7- المكعب Cubic ...
أرسل بواسطة: حور العين في ديسمبر 15, 2006, 06:05:17 مساءاً
شكرا لك اخى " جيولوجي"
موضوع المعادن موضوع طويل وبحت جدا, وكنا أيام الجامعه حتى نفهم المعادن جيدا , كنا نعمل " بالورق المقوى" أشكال البلورات الهندسية. ونرسم عليها " أنا كنت أكتب عليها ذكري حور ومها ومشاعل..."
QUOTE
لكن مالذي يحكم انتظام ذرات العناصر في الفراغ الهندسي .. ؟
أما هذه النقطة لو كانت تملك شرحا وافيا لها أكون مشكورة ...لأنها دائما مانتطرق لها باختصار ...فأتمنى كثيرا من التفصيل.
شكرا لك..
حور
أرسل بواسطة: geologe في ديسمبر 15, 2006, 06:15:57 مساءاً
شكرا لك على متابعتك وتعليقك ..
ان شاء الله يكون الجاي يحمل الكثير من التفصيل عن الكيفية التتي تترتب بها المعادن في الفراغ الهندسي بما يشبع فضولك العلمي ..
في أمان الله
أرسل بواسطة: geologe في ديسمبر 15, 2006, 06:19:13 مساءاً

لاحظ كيف انتظمت الذرات في الفراغ الهندسي لتعطينا بلورة على شكل مكعب ..
هذا الشكل الكبير يوجد بداخله أشكال أصغر منه تشبهه وتمثله تسمى الوحدة الخلية Unit cell تجمع هذه الوحدات الصغيرة يعطي البلورة الكبيرة ..
إذن كل بلورة معدن مكونة عدد كبير من وحدات الخلية المتشابهة التي تتجمع مع بعضها لتعطي الشكل البلوري .
ويمكننا تعريف الوحدة الخلية Unit cell بأنها شكل هندسي متعدد الأوجه وله عدة أركان ، يحتل كل ركن ذرة عنصر أو أيون أو كاتيون تعدد هذه الوحدة الخلية وتجمعها مع بعضها هو الذي يعطي الشكل الخارجي للمعدن ..
أبسط أشكال الخلية الوحدة هي تلك الخلية التي تشكل البلورة الموضحة في الأعلى حيث أنها تتكون من ثمانية أركان يحتل كل ركن منها ذرة عنصر وتسمى Primitive ويرمز لها بالرمز p وتظهر كما في الشكل التالي :

وهناك شكل آخر يعتبر من أبسط الأشكال أيضاً ويشبه الـ Primitive إلا أن زواياه غير قائمة ويسمى Rhombohedral ويظهر كما في الشكل التالي :

مما سبق عرفنا أن الوحدة الخلية Unit cell عبارة عن شكل هندسي متعدد الأوجه وعلى قمته ثماني ذرات ، إذا كانت أبعاده متساوية وزواياه قائمة يسمى Primitive وإذا كانت الزوايا متساوية ولكن لا تساوي 90 يسمى Rhombohedral .
--------------------------------------
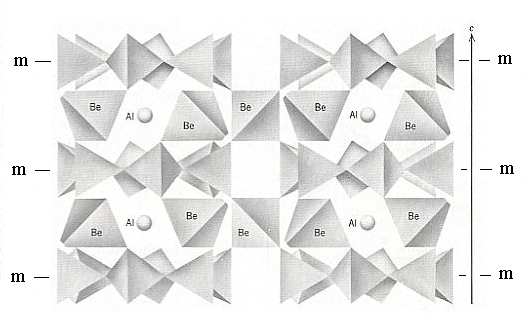
جميعنا يعلم أن البلورة لها ثلاثة محاور بلورية هي a و b و c وتظهر كما في الشكل التالي ..

ويسمى الوجه المقابل للمحور a بالوجه a أو a face والوجه المقابل للمحور b بالوجه b أو b face والوجه المقابل للمحور c بالوجه c أو c face
نعود لموضوعنا ...
ماذا لو كان عدد الذرات في الخلية الوحدة الـPrimitive أكثر من ثمانية ذرات ..؟
في هذه الحالة نطلق عليها اسم Non-primitive ولها عدة حالات هي كالتالي ..
1- خلية وحدة لا أولية ممركزة على الوجه a وفيها يصل عدد الذرات إلى عشرة ذرات تتوزع ثمانية منها على الأركان كالـ Primitive أما الذرتين الباقيتين فتتوزع في مركز الوجه a كما في الشكل التالي ..

2- خلية وحدة لا أولية ممركزة على الوجه b وهي مثل الخلية السابقة وإنما تكون الذرتين الإضافيتين في وسط الوجه b
3- خلية وحدة لا أولية ممركزة على الوجه c وفيها تكون الذرات الإضافية في وسط الوجه c
4- خلية وحدة لا أولية تتوزع فيها 14 ذرة 8 منها على الأركان و6 في أوساط الأوجه ويرمز لهذه الخلية بالرمز f .
5- خلية وحدة ممركزة على الجسم وفيها 9 ذرات 8 منها على الأركان والتاسعة عند تقاطع المحاور البلورية ويرمز لهذه الوحدة الخلية بالرمز I ..
ومن خلال هذه الذرات ( التي يمثل الخط الواصل بين بعضها محاور للتناظر ) تم تقسيم الأنظمة البلورة إلى اثنين وثلاثين شكلاً بلورياً .
يتبع ..
أرسل بواسطة: geologe في ديسمبر 15, 2006, 06:34:43 مساءاً
وعرفنا أن البلورة عبارة عن جسم صلب يتميز بتركيب كيميائي معين وترتيب ذري داخلي محدد ويتحدد شكل البلورة في الفراغ بأوجه بلورة يتحدد عددها بحسب ظروف تكونها ..
وتحدثنا أيضاً وأنه بعد اكتشاف الأشعة السينية فقد استخدمت في دراسة البناء البلوري الداخلي للمعادن لاكتشاف مواقع الذرات وأحجامها ونوعية الروابط الكيميائية فيما بينها وتأكد العلماء من خلالها أن المعادن تتميز بترتيب ذري داخلي منتظم وأن هذه المعادن تتكون من لبنات متشابهة تتكرر في الفراغ الهندسي لتعطينا الشكل الخارجي لبلورة المعدن وأُطلق على هذه اللبنات اسم الخلية الوحدة Unit cell ..
وذكرنا أن الخلية الوحدة عبارة عن شكل هندسي متعدد الأوجه Polyhedral له ثمانية أركان- يحتلها ذرة عنصر أو أيون أو كاتيون - أبعاده متساوية والزوايا في بينها قائمة ، هذا في حالة الـ Primitive أما في حالة الـ Non-primitive فتتمركز ذرات إضافية على أوجه أو في وسط البلورة ..
عند دراستنا للبناء البلوري الداخلي يهمنا جداً معرفة نوعية الرابطة التي تربط بين الذرات ومدى قوة الرابطة ..
فالرابطتين الأيونية والتساهمية تعتبر من أقوى الروابط الكيميائية تليها الرابطة الهيدروجينية ثم رابطة فاندرفالز التي تظهر عندها مناطق الضعف و الانفصام Cleavage وهناك بعض القوانين التي تحكم ارتباط الذرات والأيونات مع بعضها ..
فالأيونات السالبة تنجذب نحو الأيونات الموجبة والأيونات الموجبة تنجذب نحو الأيونات السالبة بمعنى آخر أن الأيونات المختلفة الشحنة تتجاذب مع بعضها والأيونات المتشابهة تتنافر ..
تذكر أن الأيونات إما أن تكتسب أو تفقد إلكتروناتها .. ففي حالة الفقد تصبح موجبة الشحنة ويصغر حجمها وتسمى كاتيون وفي حالة الكسب تصبح سالبة الشحنة ويزيد حجمها وتسمى آنيون والفرق الجوهري بين هذه الأيونات يعتمد على كمية الشحنة على النواة ويتحدد مقدار هذه الشحنة بعدد الالكترونات التي تفقد أو تكتسب ..
بالنسبة للروابط يمكن تقدير طول الرابطة بالمسافة بين مركزي نواتي الذرتين فإذا كانت الذرتين متساويتين في الحجم يكون طول الرابطة ضعف طول نصف قطر الذرة ..
وتحدد أنصاف أقطار الأيونات بوحدة الأنجستروم ..
أرسل بواسطة: geologe في ديسمبر 15, 2006, 06:43:23 مساءاً
وفي أي جزيء أو بناء بلوري فإن أي ذرة أي أيون تكون محاطة بأيونات أو ذرات أخرى مخالفة لها في الشحنة لذلك فإن عدد الذرات أو الأيونات المحيطة بالذرة المركزية يسمى عدد التناسق Coordination Number ..
إذن عندما ترتبط ذرات العناصر مع بعضها بقوى اكتروستاتيكية فإن أي أيون مركزي يحاول أن يجمع حوله أكبر عدد من الأيونات أو الذرات المخالفة له في الشحنة ، هذا العدد من الأيونات المنجذبة إلى الذرة المركزية يسمى عدد التناسق ..
ويعتمد عدد التناسق على كمية الشحنة ونصف قطر الأيون ..
* أنواع التناسق :
1- غير مستقر Unstable
ويحدث إذا كانت الذرة المركزية أصغر من الذرات المحيطة به وتتلامس معه مباشرة لكن الذرات المحيطة لا تتلامس مع بعضها ويحتاج إلى طاقة أقل للتفكك ..
2- most stable أكثر استقراراً
وفيه يتلامس الأيون المركزي مع الأيونات المحيطة به والأيونات المحيطة تتلامس مع بعضها ويحتاج إلى طاقة كبيرة جداً حتى يتفكك
3- stable مستقر
وفيه تتلامس الأيونات المحيطة مع بعضها ولا تتلامس مع الأيون المركزي ..
* كيفية تمثيل عدد التناسق ..
أولاً تذكر أن كمية الشحنة التي تشارك بها الذرة المركزية تساوي كمية الشحنة التي تشارك بها الذرات المحيطة ..
فمثلا لو كانت شحنة الذرة المركزية +2 ومحاطة بأربعة أيونات شحنة كل منها -1 فعندها تتوزع شحنة الذرة المركزية بالتساوي على الأيونات الأربعة ليحصل كل أيون على نصف شحنة وفي نفس الوقت يشارك الأيون المحيط بنصف شحنته ليبقى النصف الآخر نشطاً قابلاً للارتباط بأيونات أخرى ..
لذلك ومع هذا التساوي في الشحنات تكون المسافات بين الذرة المركزية والأيونات المحيطة متساوية وبالتالي فإن ارتباط هذه الأيونات مع بعضها يعطي أشكالاً هندسية منتظمة
فعندما يكون عدد التناسق 4 ( الذرة المركزية محاطة بأربعة أيونات ) فيمكن تمثيل ذلك بواسطة الشكل الهندسي ثلاثي الأوجه Tetrahedron كما في الشكل التالي

وعندما يكون عدد التناسق 6 فيمكن تمثيله بثماني الأوجه Octahedron كما في الشكل التالي ..

وعندما يكون عدد التناسق 8 فيمكن تمثيله بالشكل المكعب كما في الشكل التالي ..

أما أعداد التناسق التي لايمكن تمثيلها بشكل هندسي فتسمى بأرقامها مثل التناسق الثلاثي والعشري ..
وتتدخل في كثير من الأحيان الرابطة الكيميائية في تغيير نصف قطر الأيون وبالتالي تغير عدد التناسق .. فمثلاً أيون الأكسجين يعطي عدد تناسق ثنائي عندما يكون نصف قطره 1.35 انجستروم ويعطي تناسق مكعب عندما يكون نصف قطره 1.42 أنجستروم
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:00:26 مساءاً
تظهر المواد الجامدة المرتبطة أيونياً وخاصة البنيات البسيطة منها بعض الخصائص التي لخصها باولينج Pauling في النقاط التالية والمعروفة بقواعد باولينج Pauling rules
1- تنتظم الأيونات في التناسق المتعدد الأوجه حول كل كاتيون بحيث تكون المسافة بين مركز كل من الكاتيون والآنيون ( طول الرابطة الكيميائية ) مساوية لمجموع أنصاف أقطارهما ويمكن تعيين عدد التناسق للكاتيون عن طريق نسب أنصاف الأقطار ..
كيف يمكن تعيين عدد التناسق للكاتيون عن طريق نسب أنصاف الأقطار ..؟
يعتمد عدد الأنيونات حول أي كاتيون على النسبة بين نصف قطر الكاتيون إلى نصف قطر الآنيون فحول الكاتيونات الكبيرة الحجم يزداد عدد الآنيونات ويقل هذا العدد حول الكاتيونات ذات الأحجام الصغيرة وتميل الأنيونات إلى الارتباط ببعضها بشكل ملتصق ما أمكن ذلك ..
ويعرض الجدول التالي ( عن : ماسون Mason 1966 ) أعداد التناسق المقترحة والتنظيم المستقر للأنيونات حول كل كاتيون وذلك تبعاً لقيمة النسبة بين نصفي القطرين

ولقد بينت الدراسات وجود توفق جيد بين أعداد التناسق المتوقعة ( المحسوبة ) والملاحظة للكاتيونات الأكثر انتشاراً في معادن الصخور المختلفة كما في الجدول التالي ...

تعطي بعض العناصر قيماً لنسبة نصف القطر تؤهلها لوجود تناسقين بدلاً من تناسق واحد فقط ..
فمثلاً عنصر الألمنيوم الذي يعطي قيمة نسبة نصف القطر بينه وبين الأكسجين 0.38 كما هو موضح بالجدول في الأعلى وهذه القيمة تقترب من نسبة نصف القطر 0.41 المميزة للتناسقين السداسي والرباعي ، وفعلا نجد الألمنيوم موجود في الطبيعة في هذين التناسقين وذلك تبعاً لدرجات الحرارة السائدة أثناء دخوله في المركبات المختلفة . فيوجد الألمنيوم في التناسق الرباعي وذلك بالإحلال محل السيلكون في معادن الفلسبارات ، أما في المعادن المتكونة عند درجات الحرارة المنخفضة فيوج الألمنيوم في التناسق السداسي كم في معدن الجبسيت Al(OH)3 ..
وللضغط تأثير كبير على أعداد التناسق أمكن ملاحظته في معادن أكسيد السيلكون SiO2 المتعددة الشكل حيث يوجد السيلكون في معدن الإستيشوفيت الذي يتكون في ظروف الضغوط العالية في تناسق أعلى من التناسق الرباعي المعروف للسيلكون في المعادن السيلكاتية الأخرى مثل الكوارتز ..
يتبع ..
* المصدر :
أسس الجيوكيمياء
محمد أحمد قزاز ، أحمد حسنين حشاد
الـطـبعـة الأولى 1420 هـ
الناشر : مركز النشر العلمي بجامعة الملك عبد العزيز
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:06:33 مساءاً
في الجدول المدرج في الرد السابق لاحظنا أن علاقة نصف القطر أو نسبة نصف القطر دائماً ماتكون قيمتها أقل من الواحد الصحيح .. وهذا يدل على أن نصف قطر الكاتيون أصغر من نصف قطر الآنيون ..
لكن في حالة كانت أنصاف الأقطار متساوية فتكون قيمة نسبة نصف القطر مساوية للواحد الصحيح وتكون عادة في المعادن الغير سليكاتية ويكون عدد التناسق لها 12 ..
تلاقي الذرات المتساوية في الحجم يعطي فراغات فيما بينها على شكل مثلثات تسمى B-Void أو C-Voide كما في الشكل التالي ..

وإذا جاءت طبقة أخرى من الذرات المتساوية في نصف القطر فإنها ستترتب في الفراغات B أو C فإذا سقطت في الفراغ B ثم تلتها طبقة أخرى من الذرات موازية للطبقة الأولى ولتكن A فيكون الترتيب A,B,A و يسمى في هذه الحالة hexagonal closest packing أما لو سقطت الطبقة الثالثة في الفراغ C فيكون الترتيب A , B , C ويسمى في هذه الحالة Cubic closest packing وتظهر كما في الشكل التالي

يتبع ..
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:08:31 مساءاً
في الرد السابق تحدثنا عن علاقة نصف القطر وعرفنا أنه وعندما تكون علاقة نصف القطر تساوي واحد فإن التناسق سيكون اثنا عشري ويندر وجود هذا التناسق إلا في الفلزات الطليقة والسبائك ..
لاحظ أن قيمة نسبة نصف القطر متناقصة فهي تبدأ من 1 بعدد تناسق اثنا عشري وتبدأ في التناقص لأقل من الواحد لينقص معها عدد التناسق ..
لاحظ أيضاً أنه كلما صغر حجم الأيون المركزي ( نصف قطره ) فبالتالي سيقل عدد التناسق حيث تقل عدد الأيونات المحيطة بالأيون المركزي ..
وتكون الأيونات المحيطة مستقرة عندما يكون الأيون المركزي صغير لدرجة أن الأيونات المحيطة تتلامس معه بالإضافة إلى أنها تتلامس مع بعضها ، وتتحقق هذه الحالة عندما يحيط بالأيون المركزي 8 أيونات وهي التناسق الأكثر استقراراً بعد التناسق الإثنى عشري ويكون عندها نسبة نصف القطر تساوي 0.732 ..
وهذا يعني أنه توجد تناسقات عشرية وأحد عشرية إلى أنها غير مستقرة أي أنها غير محققة لشروط الاستقرار ..
وشرط الاستقرار كما ذكرنا سابقاً أن يكون الأيون المركزي صغير لدرجة أنه يتلامس مع الأيونات المحيطة به وتتلامس هذه الأيونات مع بعضها البعض ..
وإذا كان التناسق Octahedron أي عدد التناسق 6 ففي هذه الحالة تكون نسبة نصف القطر 0.414 وإذا كان عدد التناسق أربعة فإن نسبة نصف القطر تساوي 0.224 من ذلك نلاحظ أن عدد التناسق يتناقص بتناقص نسبة نصف القطر وقد لاحظنا ذلك في الجدول السابق الذي يعرض نسبة نصف القطر لبعض الكاتيونات مع الأكسجين ...
وتتأثر أعداد التناسق بقوة الشحنة الكهربية وخصائص الأيون المركزي وهناك بعض الكاتيونات التي يختلف حجمها ومع اختلاف حجمها تتغير نسبة نصف القطر وبالتالي تتغير أعداد التناسق كما ذكرنا سابقاً ويرجع سبب تغير حجم الكاتيونات إلى القوة المحيطة بها ونوعية الروابط الكيميائية ..
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:09:15 مساءاً
2- يساوي تكافؤ أي أنيون في البنيات الأيونية الثابتة بالضبط أو تقريباً مجموع الروابط الالكتروستاتيكية المؤثرة عليه من الكاتيونات المجاورة ( طبعاً مع اختلاف الشحنة ) وتضع هذه القاعدة في الاعتبار أن البلورات يجب أن تكون متعادلة الكتروستاتياً وقد سبق أن تحدثنا عن هذا سابقاً وذكرنا مثالاً فقلنا لو كانت شحنة الذرة المركزية +2 ومحاطة بأربعة أيونات شحنة كل منها -1 فعندها تتوزع شحنة الذرة المركزية بالتساوي على الأيونات الأربعة ليحصل كل أيون على نصف شحنة وفي نفس الوقت يشارك الأيون المحيط بنصف شحنته ليبقى النصف الآخر نشطاً قابلاً للارتباط بأيونات أخرى ..
..
3- يقلل وجود حواف مشتركة أو على وجه الخصوص أوجه مشتركة في البنيات المتناسقة من استقراريتها ويكون هذا التأثير كبيراً بالنسبة للكاتيونات ذات التكافؤات العالية والأعداد التناسقية المنخفضة ويعود سبب ذلك إلى ميول الكاتيونات إلى الابتعاد عن بعضها ما أمكن ذلك ( الشحنات المتشابهة تتنافر ) وعندما يحدث اشتراك في الحواف أو الأوجه فإن الكاتيونات تصبح بذلك متلاصقة تقريباً مما يؤدي إلى حدوث التنافر فيما بينهم وبالتي تتعرض البنيات البلورية للتشوه وتقل إضافة إلى ذلك استقراريتها ..
4- في الأشكال المتعددة الأوجه التي تحتوي بلوراتها على كاتيونات متنوعة لا تميل الأجزاء التي تحتوي على الكاتيونات عالية التكافؤ إلى اقتسام الأركان أو الحواف أو الأوجه وهذا يعكس التنافر المتبادل بينهم ليعطي بنيات أكثر استقراراً ..
5- يميل عدد المكونات في البنية البلورية إلى أن يكون أقل ما يمكن وتعني هذه القاعدة أن التنظيم البلوري لأي آنيون أو أي كاتيون يميل لأن يكون متجانساً في جميع أجزاء البلورة أي أن كل عنصر يميل إلى نوع واحد من التناسق غير أن هذه القاعدة لا تنطبق على العديد من المعادن حيث نجد أيونات الأكسجين أكثر الأيونات انتشاراً في المواد الجيولوجية حيث أنها توجد في بيئات بنائية مختلفة ..
* المصدر :
أسس الجيوكيمياء
محمد أحمد قزاز ، أحمد حسنين حشاد
الـطـبعـة الأولى 1420 هـ
الناشر : مركز النشر العلمي بجامعة الملك عبد العزيز
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:10:43 مساءاً
يوجد في الطبيعة مجموعة كبيرة من المعادن التي تتشابه في شكلها البلوري وبناءها الداخلي إلى أنها تختلف في تركيبها الكيميائي وتسمى هذه الظاهرة ( التشابه في الشكل الخارجي والاختلاف في التركيب الكيميائي بـ Isomorphism
عكسها على النقيض
الـ Polymorphism
وهي التشابه في التركيب الكيميائي والاختلاف في الشكل الخارجي فمثلاً معادن الفلسبار البوتاسي ( الساندين ، الميكروكلين ، الأورثوكليز ) تركيبها الكيميائي KAlSi3O8 ولكنها تختلف عن بعضها في الشكل الخارجي ..
إذن مما سبق نعلم أنه يمكن لذرات عناصر مختلفة أن تترتب في نفس النظام البلوري ويمكن أيضاً أن توجد ذرات عناصر متشابهة إلا أنها تترتب في أنظمة مختلفة ويعتمد ذلك على ظروف تكونها وسنتحدث عن ذلك بالتفصيل لاحقاً ..
وهذا يعني أن الذرات على الرغم من اختلافها إلا أنها قد تتشابه في أحجامها ومواقعها داخل البناء البلوري وبالتالي يصبح بالإمكان أن تحل محل بعضها ويسمى المكان الذي تحل فيه الذرة بمكان التسكين Ionic site ويمكن تعريفه بأنه المكان الذي يمكن أن يشغله أيون معين في مركب كيميائي معين ذو بناء بلوري محدد ..
مثلاً الألمنيوم في KAlSi3O8 يختلف عن الألمنيوم الموجود في CaAl2Si2O8 وذلك طبقاً لملائمة شحنته ونصف قطره لأن يتواجد في هذا المكان ..
تذكر أن كل مكان تسكين له حجمه وشحنته ولذلك يجب أن يتوائم الأيون المراد تسكينه مع حجم مكان التسكين وشحنته بحيث يكون حجم الأيون في نفس حجم مكان التسكين ويختلف عنه في الشحنة ..
ومما سبق نعلم أن التركيب الكيميائي لا يكفي لتحديد ماهية المعدن إذ لابد من معرفة الشكل الخارجي لتحديد المعدن بدقة ..
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:12:24 مساءاً
نظرياً يوجد لدينا حوالي 3000 معدن والمعروف منها والمتأكد من وجوده حوالي 200 معدن ، وتنقسم هذه المعادن المتأكد من وجودها إلى قسمين هما
1- معادن واسعة الانتشار .
2- معادن قليلة الانتشار .
أيضاً في الـ 200 معدن وجد أن بعض المعادن تتشابه ولها أصول مختلفة فمثلاً قد نجد معدن ما له أصل بركان يتشابه مع معدن آخر له أصل رسوبي لاحظ أن لها أصول مختلفة إلا أنها تتشابه في الصفات ، وأحياناً أخرى نجد معادن ذو أصول مشتركة إلا أنها تختلف عن بعضها في الصفات ..
هذا الاختلاف دعى العلماء إلى دراسة الصفات المشتركة وترتيبها حسب أهميتها ومن ثم استخدام هذا الترتيب في بناء نمط تقسيمي للمعادن فقسمت بناءً على شكلها الخارجي ثم قسمت بناء على الصفات الطبيعية وأخيراً قسمت حسب تواجدها وأصولها المشتركة ..
وفي منتصف القرن التاسع عشر الميلادي ظهر لنا التركيب الكيميائي كنمط للتقسيم والذي أصبح أكثر استعمالاً من جميع الأنماط السابقة و بها قسمت المعادن حسب تركيبها الكيميائي Chemical classification الذي يعطي مدلولاً على أصول هذه المعادن وتواجدها في الطبيعة وعلى هذا النمط قسمت المعادن اعتماداً على المجموعة الأنيونية السائدة فنحن نعلم أن كل معدن مكون من شقين ( آنيون ، كاتيون ) فقسمت جميع المعادن على حسب شقها الآنيوني فمثلاً المعادن التي يكون شقها الأيوني هو الأكسجين جمعت في رتبة واحدة وسميت رتبة الأكاسيد Oxides Class والمعادن التي شقها الآنيوني CO3 جمعت في رتبة واحدة وسميت رتبة الكربونات Carbonate Class وهكذا وبذلك قسمت المعادن إلى رتب Classes اعتماداً على الآنيون أو المجموعة الأنيونية السائدة وتقسم هذه الرتب إلى تحت رتب Subclass بناءً على البناء البلوري للمعدن ..
وظل هذا التقسيم هو التقسيم السائد حتى يومنا هذا وذلك لأن :
1- جميع المعادن التي تشترك في نفس الآنيون لها صفات عامة مشتركة ( عائلية ) وهذه الصفات أكثر وضوحاً من الصفات التي تظهر في المعادن المشتركة في الكاتيونات .
2- المعادن ذات الآنيون المشترك تتواجد عادة في بيئة جيولوجية متشابهة .
3- أن هذا النمط من التقسيم يتوافق مع التقسيم الكيميائي العلمي لتسمية وتصنيع المركبات الكيميائي الغير عضوية .
وبعد أن ظهرت تقنية دراسة المعادن بواسطة المجهر الالكتروني أضيف إلى التقسيم عامل آخر وهو البناء البلوري بالإضافة إلى التركيب الكيميائي وسمي هذا التقسيم Crystal Chemical Classification وهي الأساس في علم كيمياء البلورة Crystal Chemistry وهو العلم الذي يبحث في التركيب الكيميائي والصفات الطبيعية للمعدن مع البناء الداخلي و بها قسمت الرتب إلى تحت رتب ...
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:24:10 مساءاً
1- Elements Class
2- Sulfides Class
3- Halides Class
4- Oxides Class
5- Carbonates Class
6- Sulfates Class
7- Phosphates Class
8- Silicates Class
9- The Organics Class
وقد أفردت رتبة السيليكات Silicates Class لوحدها في بعض التقسيمات لكونها الوحيدة التي تحتوي على السيلكون في تركيبها الكيميائي لذلك في الدراسات العامة تقسم المعادن إلى مجموعتين :
1- معادن سيليكاتية
2- معادن غير سليكاتية
أيضاً من الدوافع التي أدت إلى دراسة معادن السيليكات بتفصيل أكبر انتشارها الواسع في الصخور حيث أنها تمثل 25% من المعادن المعروفة و40% من المعادن الأكثر انتشاراً و90% من المعادن المكونة لصخور القشرة الأرضية ..
وكما ذكرنا سابقاً ما يميز هذه المجموعة هو وجود عنصر السليكون فيها المرتبط مع الأكسجين .. ولاحظ أن نصف قطر أيون السيلكون يساوي 0.42 أنجستروم ونصف قطر الأكسجين 1.4 أنجستروم وبذلك تكون علاقة نصف القطر 0.3 والبناء البلوري SiO4 ويظهر كما في الشكل التالي ..

كيميائيا فإن تكافؤ السيلكون يساوي +4 أما الأكسجين فيساوي -2 وبذلك وحسب قواعد باولينج Pauling rules فإن كل شحنة موجبة في السليكون ترتبط بأخرى سالبة في الأكسجين وبالتالي تظل الـ SiO4 نشطة لوجود الشحنات السالبة الحرة من شحنات الأكسجين قابلة للارتباط بأيون موجب آخر وهذا ما أعطانا التعددية في تحت الرتب Subclass بالنسبة لرتبة السيلكون ..
إذن المدخل لتقسيم رتبة السليكات إلى تحت رتب هو الشحنات السالبة الموجودة على أطراف وحدة رباعي الأوجه السليكاتي وبالتالي طريقة ارتباط هذه الوحدات مع بعضها ..
وهذا مايجعلنا نتسائل كيف ترتبط وحدات رباعي الأوجه مع بعضها البعض ..؟
هذا ما سنعرفه في الرد القادم بمشيئة الله تعالى
أرسل بواسطة: geologe في ديسمبر 15, 2006, 09:34:17 مساءاً
فكيف ترتبط رباعيات الأوجه مع بعضها ..؟
هناك احتمالين أو طريقتين لارتباط رباعيات الأوجه مع بعضها البعض ..
الأولى ..
أن يتم الارتباط بين رباعيات الأوجه عن طريق كاتيون مختلف كما في الشكل التالي ..

والثانية ..
أن يكون الارتباط بين اثنتين من رباعيات الأوجه أو أكثر بواسطة أكسجين مشترك كما في الشكل التالي .

لاحظ كيف اشتركت رباعيتي الأوجه في أكسجين واحد وأصبح بينهما اشتراك في الرأس ..
وقد تشترك في أيوني أكسجين ويصبح بينهما اشتراك في الحواف .. أو تشترك في ثلاثة أيونات ويصبح بينهما اشتراك في الوجه .. << حاسس انو هادي النقظة ماهي واضحة لكن أوعدكم انها راح توضح من خلال الردودو القادمة بمشيئة الله تعالى
إذن تقسم رباعيات الأوجه إلى تحت رتب اعتماداً على بناءها البلوري واعتماداً على الكيفية التي تتعدد فيها رباعيات الأوجه السليكاتية في البناء البلوري ..
وهذه التحت رتب هي ..
1- نيزوسيليكات Nesosilicates
2- سوروسيليكات Sorosilicates
3- سيكلوسيليكات Cyclosilicates
4- اينوسيليكات Inosilicates
5- فيللوسيليكات Phyllosilicates
6- تكتوسيليكات Tectosilicates
وعلشان تسهل عليكم رتبتها لكم في الجدول التالي ..

وراح نتكلم عن هذه التحت رتب وحدة وحدة في الردود القادمة بمشيئة الله تعالى ..
المصادر
http://www.uwgb.edu/dutchs/EarthSC202Notes/minerals.htm
6http://mineral.galleries.com/minerals/by_class.htm
أرسل بواسطة: حور العين في ديسمبر 15, 2006, 11:08:28 مساءاً
ماشاء الله عليك " كفيت ووفيت فى شرح تركيب المعادن"
عن جد شكرا لك...
وننتظر المزيد....
حور
أرسل بواسطة: الدمع في ديسمبر 16, 2006, 09:13:24 صباحاً
الأخ الفاضل .. geologe
الصراحة تعبت وأنا أقرأ الكلام الكثير ، واستمتعت به كثيراً وبالصور المرفقة ودقتها وجمالها
في الحقيقة أخي أن هذا جهد رائع ومفيد كثيرأً ، فبارك الله فيك ونفع بك كثيراً .
عندي ملاحظة على إحدى الرسومات الموجودة في المشاركة رقم 6 .. ذكر عن المكعب أن له ثمان رؤوس ( أو نقط سوداء ) ولكن في الرسم وضعت عليه سبع نقاط سوداء .. فهل هذا من ضمن خصائص الشكل بحيث لا تضهر إحدى الرؤوس أم أنه يكون خطأ مطبعي في الرسم ؟
لأن الشكل تكرر مرتين
وصدقني أنك ستنال الكثير من الدعاء للمستفيدين من هذا الموضوع والمتخصصين .
لك كل الشكر والحترام على تقديمك وعرضك .
أخوك .. الدمع
أرسل بواسطة: geologe في ديسمبر 16, 2006, 06:33:53 مساءاً
العفو وسعيد انو الموضوع عجبك ..
=========
أخويا الدمع
QUOTE
عندي ملاحظة على إحدى الرسومات الموجودة في المشاركة رقم 6 .. ذكر عن المكعب أن له ثمان رؤوس ( أو نقط سوداء ) ولكن في الرسم وضعت عليه سبع نقاط سوداء .. فهل هذا من ضمن خصائص الشكل بحيث لا تضهر إحدى الرؤوس أم أنه يكون خطأ مطبعي في الرسم ؟
كان في خطأ مطبعي في الرسم ، معليش ما انتبهت للخطأ
شكراً على تنبيهك وتم تصحيح الخطأ
في أمان الله
أرسل بواسطة: طرزان في ديسمبر 17, 2006, 05:15:42 صباحاً
ياريت يكون الرد قب الاثنين لانى عندى امتحان فيهم الاثنين
أرسل بواسطة: geologe في ديسمبر 23, 2006, 08:37:51 مساءاً
على كل حال قريبا جدا راح أكتب لك موضوع عن الخواص البصرية للمعادن
وان شاء الله تكون سويت تمام في الاختبار
بالتوفيق لك
وفي أمان الله
أرسل بواسطة: geologe في ديسمبر 23, 2006, 08:44:48 مساءاً
لاحظ أن هذه الصيغة ليست صيغة كيميائية فحسب وانما تدل أيضاً على البناء الذري الداخلي فوجود SiO4 في الصيغة بحيث تكون نسبة السليكون إلى الأكسجين 1 إلى 4 فهذا يدل على أن رباعيات الأوجه السليكاتية تتكرر في البناء الذري بصورة مفردة عن طريق كاتيون مختلف مثل الحديد كما في حالة الفياليت أو المغنسيوم كما في معدن الفروشتريت لذلك تسمى هذه الصيغة بالصيغة الكيميائية البنائية لأن بها إشارة إلى شكل البناء الداخلي للمعدن ..
تذكر أن الكاتيونات ليست متشابهة ففي معدن الفياليت كان الكاتيون هو الحديد وفي معدن الفياليت كان المغنسيوم لذلك سنجد أن هناك الكثير من الكاتيونات التي من الممكن أن ترتبط بين رباعيات الأوجه وهي حتماً ستختلف عن بعضها في حجمها وشحنتها ( تكافؤها )
لذلك وضعت الصيغة العامة لمعادن السليكات عن النحو التالي ..

وتعبر هذه الحروف عن الصيغة الكيميائية البنائية لمعادن السليكا حيث أن :
X و Y هي مواقع لتسكين الكاتيونات Ionic Site ولهذه الكاتيونات حجمها وشحنتها ..
فمكان التسكين X تسكن فيه الكاتيونات الكبيرة الحجم ضعيفة الشحنة والتي عادة مايكون تناسقها في النظام المعكعب أم مكان التسكين Y فتسكن فيه الكاتيونات صغيرة الحجم تتراوح شحنتها مابين 2 إلى 4 وتناسقها Octahedron كما في المثال التالي ..

بالنسة لـ (ZO) فهي التي تحدد نسبة السليكون إلى الأكسجين وهي التي يرتكز عليها البناء البلوري فـ Z مكان تسكين للأيونات صغيرة الحجم مرتفعة الشحنة وعدد تناسقها 4 وهي في هذه الحالة أيونات السليكون وأحياناً قد تكون أيونات ألمنيوم كما سنذكر لاحقاً .. و O هي مكان تسكين الأكسجين
نأتي للمكان الأخير W فيخص الأيونات الإضافية والتي لها أماكن تسكين مخصصة مثل OH - Cl - H - CO3 - SO4
أما الحروف الصغيرة m,n,p,q :
فـ p و q تعبر عن درجة التعددية لرباعيات الأوجه السليكاتية وتسمى درجة البلمرة أو درجة تعددية رباعيات الأوجه
و m , n , r فتستخدم لمعادلة الصيغى كهربياً بحيث تساوي عدد الأيونات الموجبة عدد الأيونات السالبة ..
وبذلك نكون قد انتهينا من الحديث عن أسس تصنيف المعادن السليكاتية ، والصيغة الكيميائية البنائية للنتقل من خلال الردود القادمة لحديث عن تحت الرتب التي قسمت إليها رتبة السليكات والتي سبق أن شرحناها في جدول سابق
إلى ذلك الحين لكم مني أجمل تحية
وفي أمان الله
أرسل بواسطة: geologe في ديسمبر 23, 2006, 08:54:47 مساءاً

أرسل بواسطة: geologe في ديسمبر 23, 2006, 09:44:41 مساءاً
Subclass : Nesosilicates
وتضم هذه المجموعة المعادن التيي يتكون هيكلها السيليكاتي من رباعيات أوجه Tetrahedron مستقلة تتكرر في الفراغ الهندسي بواسطة كاتيون مختلف
بمعنى آخر أن التركيب البنائي لهذه المجموعة عبارة عن رباعيات أوجه مستقلة في الفراغ الهندسي وترتبط مع بعضها بواسطة رابطة أيونية عن طريق كاتيون مختلف كما في الشكل التالي ..

وبسبب وجود الرابطة الأيونية فيندر وجود الانفصام في معادن هذه المجموعة وقد نجده في اتجاه واحد في معدن Sillimanite وتركيبه (Aluminum Silicate )
وعادة ما تكون معادن هذه المجموعة عالية الكثافة والصلادة والثقل النوعي وأهم صفاتها أن غالبية معادنها تظهر في أشكال بلورية متساوية الأبعاد ..
لاحظ أنه لايوجد إحلال للألمنيوم محل السيلكون في مجموعة الـ Nesosilicates وإن وجد فهو محدود وغير ملحوظ ..
وتضم هذه المجموعة الكثير من المعادن ويمكنك الإطلاع عليها من خلال الرابط التالي
http://www.galleries.com/minerals/silicate/nesosili.htm
من أهم المجموعات التي تضمها الـ Nesosilicate ..
1- Garnet Group ...
2- Olivine Group ...
3- Aluminum Silicate ..
وتختلف هذه المجموعات عن بعضها في حجم الكاتيون ونوع الكاتيون السائد ففي الأولفين نجد عناصر الحديد الثنائي والمغنسيوم وفي الجارنت نجد عناصر الألمنيوم والكالسيوم وطبعا في الـ Aluminum Silicate سنجد أن الألمنيوم هو الكاتيون السائد الذي يربط رباعيات الأوجه مع بعضها ..
وسنتحدث عن هذه المجموعات بالتفصيل من خلال الردود القادمة بمشيئة الله تعالى ..
أرسل بواسطة: geologe في ديسمبر 23, 2006, 11:23:40 مساءاً
وفي هذه المجموعة يكون الكاتيون السائد عبارة عن حديد ومغنسيوم ويمكن تمثيل الصيغة العامة لمعادن هذه المجموعة على النحو التالي M1 M2 (SiO4)3 حيث أن M1 و M2 مكان تسكين الكاتيونات ( الحديد والمغنسيوم ) وكلاهما في التناسق السداسي ( Octahedron) وسيتم شرح الفرق بينهما عند شرح التركيب البنائي لهذه المجموعة ..
عند استخدام أشعة اكس في دراسة البناء الذري الداخلي فإن النتائج عادة ما تظهر على شكل نقاط عشوائية توضح أماكن الذرات كما في الشكل التالي ..

وحتى تسهل دراسة هذا التركيب قمنا بتمثيل هذه النقاط على هيئة أشكال متعددة الأوجه حتى يسهل دراستها كما هو الحال مع علماء الفلك حين قامو برسم صور تخيلية للمجموعات النجمية تساعدهم على دراستها ..
على كل حال ..
عند وضع بلورة الأولفين أمام جهاز الأشعة بحيث يكون المحور a موازيا لانطلاق الأشعة فسيظهر البناء الداخلي للبلورة كما في الشكل التالي ..

لاحظ أن رباعيات الأوجه موجودة على هيئة مفردة ويربط بينهم كاتيون مختلف ..
في حالة الأولفين يوجد هناك مكانين لتسكين الكاتيونات وهما كما ذكرنا سابقاً M1 و M2 وكلاهما في التناسق السداسي ( Octahedron ) ..
بالنسبة لـموقع التسكين M1 فيظهر على شكل سلسلة من الـ Octahedron مشتركة في الحواف ممتدة على طول المحور c وتكون الـ Octahedron مشوهة بحيث يوجد اختلاف بسيط في أبعادها
أما موقع التسكين M2 فيوجد على شكل مفرد وتكون فيه الـ Octahedron متساوية الأبعاد وتظهر باللون الأخضر الداكن في الشكل الموضح بالأعلى ..
وكما ذكرنا سابقاً أن الكاتيونات السائدة في الأولفين هي الحديد ++Fe والمغنسيوم ++Mg ونظرا لتقارب أنصاف أقطارهما وتكافؤهما فلا يوجد تفضيل في تسكينهما في M1 أو M2 وأحياناً يحل الكالسيوم Ca محل الحديد ليعطي معدن المنتوسيليت Montocillite وتركيبه الكيميائي Ca Mg SiO4 ومن أِشهر معادن هذه المجموعة معدني الـ Fayalite والـ Forsterite
- معدن الفياليت Fayalite
التركيب الكيميائي : Fe2SiO4 ..
النظام البلوي : Orthorhombic ..
اللون : أخضر ، أخضر مصفر ..
التواجد الأمثل : ويوجد الفياليت في الصخور النارية المافية Mafic والفوق مافية ultramafic كما يوجد في صخور الماربل marbles والمتحولة من الحجر الجيري النقي impure limestones
- معدن الفروشتريت Forsterite
تركيبه الكيميائي : Mg2SiO4 ..
النظام البلوري : orthorhombic ..
اللون : أخضر ، أخضر مصفر yellowish green ..
التواجد الأمثل : يوجد الفورشتريت في الصخور النارية المافية Mafic والفوق مافية ultramafic كما يوجد في صخور الماربل marbles والمتحولة من dolomitic limestones كما يوجد في بعض iron-nickel meteorites .
وإذا دخل الكوارتز ضمن في التركيب الكيميائي للفروشتريت فسيعطي ذلك معدن الانستاتيت ( أحد معادن البيروكسين ) كما في المعادلة التالية :
Mg2SiO4 (forsterite) + SiO2 (quartz) = 2MgSiO3 (enstatite)
إذن تحدثنا فيما سبق عن مجموعة الأولفين وذكرنا أبرز خواصها وشرحنا التركيب الكيميائي والترتيب الذري الداخلي لها وتحدثنا عن أشهر معادنها وخواص هذه المعادن والتواجد الأمثل لها لننتقل في الرد القادم للحديث عن المجموعة التالية من مجموعات معادن الـ Nesosilicates وهي مجموعة الجارنت فتابعونا ..
المصادر :
http://www.galleries.com/minerals/silicate/olivine.htm
http://staff.aist.go.jp/nomura-k/english/itscgallary-e.htm
أرسل بواسطة: geologe في ديسمبر 28, 2006, 07:14:47 مساءاً
وكما هو الحال في جميع معادن النيزوسيليكات Nesosilicat يتكون البناء الداخلي لهذا المعدن مفردة Isolated كما في الشكل التالي ...

وترتبط رباعيات الأوجه السيليكاتية بواسطة كاتيون مختلف ..
وتسكن هذه الكاتيونات في مكانين للتسكين هما a و b ..
في الـ a site تسكن الكاتيونات الكبيرة الحجم ثنائية التكافؤ divalent cations مثل Mg, Fe, Mn or Ca في التناسق الثماني cube coordination وتكون هذه المكعبات مشوهة distorted كما في الشكل التالي ..

" لاحظ المكعبات الخضراء التي تمثل مكان التسكين a "
في الـ b site تسكن الكاتيونات الأصغر حجماً ثلاثية التكافؤ مثل (Usually Al, sometimes Fe+3, Ti, or Cr) في التناسق السداسي octahedrally coordinated كما في الشكل التالي ..

بالنسبة للصيغة العامة general formula لمعادن الجارنت فهي A3B2(SiO4)3 وكما ذكرنا سابقاً فإن a هي مكان نسكين الكاتيونات ثنائية الشحنة في الـ cube coordination أما b فهو مكان تسكين الكاتيونات ثلاثية الشحنة مثل Fe,AL,Ti,Cr في الـ octahedrally coordinated ..
وتنقسم معادن الجارنت إلى سلسلتين على حسب نوعية الكاتيون في الـ a site والـ b site
فإذا سكن الألمنيوم في الـ b site فهذا يعطي سلسلة معادن الـ Pyralspite وتتضمن :
Pyrope- Mg3Al2(SiO4)3
Almandine - Fe3Al2(SiO4)3
Spessartine - Mn3Al2(SiO4)3
لاحظ وجود الألمنيوم في مكان التسكين B ..
وإذا سكن الـكالسيوم Ca في مكان التسكين a ففي هذه الحالة تظهر معادن سلسلة Ugrandite وتتضمن :
Andradite - Ca3Fe2(SiO4)3
Grossular - Ca3Al2(SiO4)3
Uvarovite - Ca3Cr2(SiO4)3
لاحظ ودجود الكالسيوم في ماكن التسكين A ..
تذكر أن معادن مجموعة الجارنت هي معادن تحولية التي تميز التحول العالي لذلك نجدها في صخور الشست والمايكا شست وبعض أنواع النايس والبيجماتيت كما نجدها أيضاً ضمن صخور البيرودوتيت المكونة للوشاح ..
وتتميز هذه المعادن بالثبات والاستقرار تحت الظروف المختلفة حيث أنها تتكون في في درجات حرارة عالية وتحت ضغوط مرتفعة ..
ويعتبر معدن الجارنت من الأحجار الكريمة ونعرفه في لغتنا العربية باسم العقيق .. ويتميز بألوانه الشفافة وعدم وجود الانفصام فيه .. إلا أنه يعتبر من أرخص الأحجار الكريمة بسبب انتشاره الواسع وشيوع استعماله
المصادر
http://www.uwgb.edu/dutchs/PETROLGY/Garnet%20Structure.HTM
http://mineral.galleries.com/minerals/silicate/garnets.htm
أرسل بواسطة: geologe في ديسمبر 28, 2006, 10:19:44 مساءاً
وتشتمل هذه المجموعة على ثلاثة معادن رئيسية هي :
1- Andalusite
2- Sillimanite
3- Kyanite
وتعتبر هذه المعادن الثلاثة polymorph مع بعضها أي أنها تشترك في التركيب الكيميائي Al2SiO5 وتختلف في النظام البلوري
قد يتسائل البعض لماذا SiO5 ..؟
فنحن نعلم أن نسبة السلكون إلى الأكسجين في النيزوسيليكات 1:4 لماذا أصبحت هنا 1:5 ...؟
سنجيب عن هذا التساؤل من خلال شرح الصيغة العامة والبناء الداخلي لهذه المعادن ..
فالصيغة العامة لها Al Al SiO5 وجود اثنين من الألمنيوم يدل على أن لهم مكانين للتسكين ..
ففي المكان الأول يسكن الألمنيوم على في تناسق Octahedral وتختلف المعادن الثلاثة عن بعضها في مكان التسكين الثاني ..
نصف الألمنيوم الموجود ضمن التركيب الكيميائي يوجد على شكل سلسة من الـ Octahedron متقاسمة الحواف على طول المحور C ..
وكما هو الحال في جميع معادن الـ Nesosilicate توجد رباعيات الأوجه السيليكاتية مفردة في التركيب البنائي ..
أما النصف الآخر من الألمنيوم فيتوزع في بقية التركيب ويحدد شكله اسم المعدن ونوعه ..
ففي الكيانايت يوجد على شكل Octahedron معزولة ..
أما في السليمنايت فيوجد نصف الألمنيوم على شكل رباعي الأوجه Tetrahedron تتبادل الموقع مع رباعيات الأوجه السيليكاتية ..
وفي الأندلوسيت فيوجد النصف الآخر للألمنيوم في التناسق الخماسي ..

ويوضح الشكل السابق التركيب الداخلي لمعدن السليمنايت لاحظ كيف أن نصف الألمنيوم موجود على شكل سلسة من الـ Octahedron المتقاسمة والحواف والنصف الآخر موجود على شكل Tetrahedron تتبادل المواقع مع رباعيات الأوجه السيليكاتية ..
-------------------------------------------
معدن الأندلوسيت Andalusite

اللون : أبيض ، أحمر ، بني ، برتقالي أو أخضر .
البريق : زجاجي .
النظام البلوري : Orthorhombic ..
الانفصام :موجود في اتجاهين ..
الصلادة : 7.5 ..
الوزن النوعي : 3.5
ويوجد في مناطق التحول بالتماس ويظهر في النطق حول المتداخلات النارية وبالذات في المتداخلات الغنية بالألمنيوم ..
ويتميز بأن بلوراته تظهر على هيئة منشور شبه مستدير كما يتميز بلونه الأحمر والبني ويوجد عادة متلاصقاً ومتحول إلى سيرست ( مسكوفايت دقيق التحبب )
======================
معدن الكينايت Kyanite

ولهذا المعدن خاصية عجيبة أن له صلادتين في نفس المعدن إذا تبلغ صلادته 4.5 إذا خدش في اتجاه المحور الطويل للبلورة و 6.5 إذا خدش عمودياً على المحور الطويل للبلورة ويعود سبب ذلك إلى الطريقة التي تترتب بها الأيونات في البناء الذري الداخلي ..
اللون : أزرق عادة ولكن أحياناً يظهر باللون الأخضر أو الرمادي أو الأبيض ..
النظام البلوري : Triclinic
البريق : زجاجي إلى بلوري ..
الانفصام : موجود في اتجاه واحد
الوزن النوعي : 3.58
ويوجد هذا المعدن في الصخور المتحولة بتأثير الضغط العالي ..
ويتميز بأن بلوراته تظهر على هيئة نصليه باللون الأزرق الفاقع ..
==============================
معدن السيليمنايت Sillimanite

اللون : أبيض ، أخضر أو بني .
النظام البلوري : Orthorhombic
البريق : حريري إذا كان على شكل fiberous أو زجاجي
الانفصام : موجود في اتجاه واحد ..
الصلادة : 7.5
الثقل النوعي : 3.2
ويوجد في الصخور المتحولة تحولاً إقليمياً عند درجات الحاراة العالية ( حوالي 500 درجة مئوية تقريباً )
ويتميز ببلوراته التي تظهر على هيئة اسطوانية متطاولة وكما أن انفصامه مميز له ..
بذلك نكون قد انتهينا من الحديث عن الـ Nesosilicates لننتقل في الرد القادم بمشيئة الله تعالى للحديث عن الـ Sorosilicates ..
إلى ذلك الحين لكم مني أجمل تحية ..
وفي أمان الله
أرسل بواسطة: geologe في يناير 01, 2007, 06:20:20 مساءاً
Subclass: Sorosilicates - The Double Tetrahedrons
تحت رتبة : سوروسيليكات
وتحتوي هذه المجموعة على أكثر من 70 معدن معظمها نادرة وأهم هذه المجموعات هي مجموعة الإبيدوت Epidote وهي ما سنتحدث عنه خلال الردود القادمة بمشيئة الله تعالى ..
لاحظ أن نسبة السيلكون إلى الأكسجين في السوروسيليكات Sorosilicates هي 2:7 وتظهر فيه رباعيات الأوجه متقابلة في الرأس مشتركة في واحد من الأكسجين الطرفي كما في الشكل التالي ..

وتضم هذه التحت رتبة أكثر من 70 معدن يمكن الإطلاع عليها على الرابط التالي :
http://www.galleries.com/minerals/silicate/sorosili.htm
وكما ذكرنا أن أهم هذه المجموعات هي مجموعة الإبيدوت وهي ما سنتحدث عنه في الرد القادم بمشيئة الله تعالى ..
أرسل بواسطة: geologe في يناير 10, 2007, 01:33:43 صباحاً
مجموعة الإبيدوت Epidote group
ومن أشهر معادن هذه المجموعة Allanite ، Epidote ، Zoisite
وبالنسبة للصيغة العامة لهذه المعادن فهي على الشكل التالي
X2 Y3 (SiO4) (Si2O7).OH
ويسكن في X الكاتيونات calcium, cerium, lead, strontium and/or yttrium
أما Y فيسكن فيها aluminum, iron, vanadium, magnesium and/or manganese
بالنسبة للتركيب البنائي للإبيدوت فلاحظ الشكل التالي ..

كما هو الحال في جميع معادن السوروسيليكات فإن رباعيات الأوجه السيلكاتية ترتبط مع بعضها مشتركة في واحد من الأكسجين الطرفي ( تظهر باللون الأزرق السماوي في الشكل السابق )
إضافة إليها توجد مجموعة من رباعيات الأوجه SiO4 مفردة ومتوزعة ضمن التركيب البنائي كما هو موضح باللون الأزرق الداكن ..
إضافة إلى ذلك فهناك سلسلة من الـ Octahedra مشتركة الحواف ممتدة على طول المحور B ويسكن فيها الألمنيوم الذي يظهر إما محاطاً بستة ذرات من الأوكسجين أو 4 ذرات من الأكسجين إضافة إلى اثنين من مجموعة الهيدوكسيل OH وتظهر كما في الشكل التالي ..

هناك أيضاً مكان تسكين آخر خارج السلسلة ويظهر على شكل Octahrdra مشوهة ويسكن فيه الحديد والمغنسيوم ويظهر باللون البني في الشكل السابق ..
وهناك أيضاً مكان تسكين آخر في التناسق الـ Cube ويسكن فيه الكالسيوم وأحياناً تسكن فيه بعض عناصر الأرض النادرة Rare earth elements كما هو الحال في معدن الإلنيت ..............
---------------------------------------
معدن الإلنيت Allanite

ويعرف باسم orthite في أوروبا .. ويعتبر من أشهر المعادن النادرة والسبب وكما ذكرنا سابقاً أنه يحدث أحياناً إحلال لبعض عناصر الأرض النادرة REE مثل السيزيوم واللانتنوم محل الكالسيوم في مكان التسكين الـ Cube
بالنسبة للصيغة الكيميائية لمعدن الإلنيت فهي (Ca, Ce, La, Y)2(Al, Fe)Al2O(SiO4)(Si2O7).OH
وتوجد مجموعة Al2O موازية لسلاسل الـ Octahedra التي تضم AlO6 و AlO4(OH)2 وهذا كما ذكرنا سابقاً هو قلب التركيب البنائي لمعادن الإبيدوت وتربط مجموعة السيلكيات وبقية الأيونات الأخرى بين هذه السلاسل ..
ولأن هذه السلاسل متوازية مع بعضها على طول المحور B فإن ذلك أعطى لبلورة الإبيدوت الهيئةالمنشورية ويظهر بها انفصام في اتجاه واحد على طول البلورة ..
بالنسبة للصفات الفيزيائية للإلنيت Allanite
اللون : من أسود إلى بني أو بني مزرق ..
النظام البلوري : Monoclinic
الهيئة : منشورية أو متطاولة
البريق : زجاجي أو شمعي ..
الانفصام : ضعيف في اتجاه واحد على طول البلورة ..
الصلادة : 5.5
الثقل النوعي : 3.0 - 4.2 ..
التواجد الأمثل : يوجد كمعدن إضافي في بعض الصخور النارية مثل الجرانيت granites , والسيانيت syenites, والديورايت diorites والبيجماتيت pegmatite كما يوجد بكميات قليلة في بعض الصخور المتحولة ..
تذكر أن معدن الإلنيت عبارة عن معدن مشع لذلك يجب اتخاذ الحيطة والحذر عند التعامل معه ..
------------------------------------
معدن الإبيدوت Epidote

وقد سبق أن شرحنا البناء الداخلي له وتحدثنا عن وجود رباعيات الأوجه السليكاتية المفردة إضافة إلى رباعيات الاوجه المزدوجة وهذا ما جعل التركيب البنائي له معقداً بعض الشيء ..
بالنسبة للتركيب الكيميائي له لمعدن الإبيدوت فهو Ca2(Al, Fe)Al2O(SiO4)(Si2O7)(OH)
اللون : أخضر أو فستقي أو أخضر مصفر ..
النظام البلوري : monoclinic ..
الهيئة : منشورية أو متطاولة .
الإنفصام : جيد في اتجاه واحد على طول البلورة ..
الصلادة : 6 - 7
الثقل النوعي : 3.3 - 3.5
ويعتبر انفصامه ولونه من الصفات المميزة له والتي تساعد على التعرف عليه في الحقل ..
ويتكون الإبيدوت تحت ظروف التحول الإقليمي لذلك نجده في بعض أنواع الصخور المتحولة مثل الشست والنايس ونجده أيضا حول القواطع النارية ..
------------------------------
معدن الزويسيت Zoisite

وقد عرف هذا المعدن قبل قرنين من الزمان كحجر من أحجار الزينة المحدودة الانتشار ,,
وتركيبه الكيميائي Ca2Al3(SiO4)3(OH)
اللون : متغير لكنه مشهور باللون الأخضر والأزرق إلى البنفسجي ..
النظام البلوري : Orthorhombic
الهيئة : منشورية أو متطاولة ..
الانفصام : موجود في اتجاه واحد ...
الصلادة : 6 -7
الثقل النوعي : 3.3 تقريباً
هناك معدن آخر يعتبر Polymorph لمعدن الزويسيت وهو معدن الـ Clinozoisite حيث أن تركيبه الكيميائي شبيه بتركيب الزويسيت وهو Ca2Al3(SiO4)3(OH) إلا أن الزويسيت يتبلور في فصيلة الـ Orthrhombic والـ Clinozoisite يتبلور في فصيلة الـ Monoclinic أيضاً هناك فرق آخر في الخلية الوحدة حيث أنها مضاعفة في الـ Clinozoisite عبر المحور a
بهذا نكون قد انتهينا من الحديث عن الـ Sorosilicates لننتقل في الرد القادم للحديث عن الـ Cyclosilicates إلى ذلك الحين لكم مني أجمل تحية
وفي أمان الله
المراجع :
http://www.uwgb.edu/dutchs/PETROLGY/EpidoteStructure.HTM
http://ruby.colorado.edu/~smyth/min/epidote.html
http://www.galleries.com/minerals/silicate/sorosili.htm
أرسل بواسطة: husam2220 في يناير 10, 2007, 03:05:55 صباحاً
صراحة من أفضل ما قرائته في بصريات المعادن .
أرسل بواسطة: husam2220 في يناير 10, 2007, 03:12:36 صباحاً
يا geologe إنت دكتورررررررررر ولا برفسوررررررررررررررررررر
محد يكتب هل المنهج ويكون الدقيق ويوصف هذا الوصف الجميل ويكون طالب مستحيل
أرسل بواسطة: geologe في يناير 23, 2007, 07:23:52 مساءاً
تحت رتية : السيكلوسيليكات
وفي هذه التحت رتبة تكون نسبة السيلكون إلى الأكسجين 1:3 وتتقاسم فيها رباعيات الأوجه السيليكاتية اثنين من الأكسجين الطرفي وتظهر على شكل حلقات ثلاثية أو رباعية أو سداسية كما في الشكل التالي ..

ومن المعادن التي تتكون من حلقات ثلاثية معدن Benitoite حيث تشترك ثلاثة من رباعيات الأوجه السيليكاتية في اثنين من الأكسجين الطرفي لتكوين الحلقات كما في الشكل التالي :

ومن المعادن التي تتكون من حلقات رباعية معدن Axinite أما المعادن التي تتكون من حلقات سداسية فمنها معادن البريل Beryl والتورمالين Tourmaline والكوردريت Cordierite ...
بالنسبة للمعادن التي تتكون من حلقات سداسية فهذه تكون فيها نسبة السليكون إلى الأكسجين 6:18 وتختلف فيما بينهما في التالي :
1- نوع الكاتيون المسكن في مكاني التسكين x وَ y .
2- حدوث إحلال للألمنيوم محل 2 من السيلكون في رباعيات الأوجه السليكاتية Si Tetrahedral فيصبح لدينا 2 من رباعيات الأوجه ألمونية و أربعة من رباعيات الأوجه سيليكاتية وتختلف مواقع الألمنيوم على حسب نوع المعدن فقد تكون محددة ومعروفة كما في معدن الكوردريت Cordierite أو تكون غير محددة كما في معدن الـ Indialite ..
في الرد القادم - بمشيئة الله تعالى - سنتحدث عن أشهر المعادن التي تتضمنها هذه التحت رتبة .. وسنتعرف على تركيبها البنائي وصفاتها المميزة والتواجد الأمثل لها فتابعونا ..
المصادر :
http://www.uwgb.edu/dutchs/PETROLGY/BenitoiteStructure.HTM
http://www.uwgb.edu/dutchs/EarthSC202Notes/minerals.htm
http://www.galleries.com/minerals/silicate/cyclosil.htm
أرسل بواسطة: geologe في يناير 23, 2007, 07:27:35 مساءاً
معدن البيريل Beryl

يتكون التركيب الداخلي لمعدن الـ Beryl من حلقات سداسية من رباعيات الأوجه السيليكاتية الممتدة أفقيا ورأسياً وترتبط مع بعضها بواسطة طبقة من الكاتيونات التي غالباً ما تكون من عناصر البريليوم Be والألمينوم Al ويسكن البريليوم في مكان تسكين رباعي التناسق أما الألمنيوم فيسكن في مكان تسكين سداسي التناسق Octahedral
لاحظ الشكل التالي ..

في هذا الشكل تظهر الحلقات السداسية فوق بعضها البعض فالحلقات الموضحة باللون الأصفر تعلو الحلقات السداسية الموضحة باللون الأخضر .. أما الأشكال الموضحة باللون البنفسجي فهي توضح مكان تسكين البريليوم ..
لاحظ أن البريليوم يربط ما بين الحلقات فأطرافه ترتبط مع مع أطراف رباعيات الأوجه السيليكاتية في الحلقات العلوية والسفلية ويظهر هذا واضحاً في الشكل التالي ...
نتيجة تراص الحلقات فوق بعضها البعض تتكون مجموعة من القنوات التي تسكن فيها بعض العناصر الإضافية مثل السيزيوم والربيديوم وتظهر كما في الشكل التالي ...

بالنسبة للصفات المميزة لمعدن البيريل
اللون : الأخضر والأزرق والأزرق المخضر وأحياناً يظهر باللون الـ pink واللون الأحمر .
النظام البلوري : hexagonal .
الهيئة : متطاولة أو منشورية .
الانفصام : ضعيف في اتجاه واحد ...
الصلادة : 7.5 - 8
الثقل النوعي : 2.6 - 2.9 .
ويتواجد البيريل في صخور الجرانيت والبيجماتيت والمايكا شست كما يتواجد مصاحباً لرواسب القصدير ..
المصادر
http://www.uwgb.edu/dutchs/petrolgy/beryl-cordstruc.htm
http://www.metafysica.nl/crystals_rev.html
http://www.3dchem.com/molecules.asp?ID=74
أرسل بواسطة: geologe في يناير 23, 2007, 07:30:17 مساءاً
معدن التورمالين Tourmaline

التركيب الكيميائي : (Na,Ca)(Li,Mg,Al)3(Al,Fe,Mn)6(BO3)3(Si6O18)(OH)4
ويختلف عن معدن البيريل في نوعية الكاتيونات المسكنة في x و y حيث يسكن فيهما عناصر البورون B أو الحديد Fe أو الألمنيوم Al أو المنجنيز Mn وتظهر هذه الكاتيونات على شكل طبقة تربط ما بين الحلقات كما في الشكل التالي :

ويعتبر معدن التورمالين من الأحجار الكريمة ويتبلور في النظام Hexagonal على هيئة بلورات منشورية ويظهر بالألوان الأسود أوالبني أوالأحمر أوالأزرق أوالأصفر ..
الصلادة : 7 - 7.5
الثقل النوعي : 3.0 - 3.25
ويتواجد التورمالين في صخور الجرانيت والبيجماتيت كما يتواجد كمعدن إضافي accessory mineral في الصخور النارية والمتحولة
المصادر :
http://www.umanitoba.ca/geoscience/faculty/arc/tourmaline.html
http://www.galleries.com/minerals/silicate/buergeri/buergeri.htm
أرسل بواسطة: geologe في فبراير 18, 2007, 09:32:41 مساءاً
Manual of Mineralogy
By James D. Dana
مع تمنياتي للجيميع بالتوفيق
وفي أمان الله
أرسل بواسطة: حور العين في فبراير 18, 2007, 09:48:33 مساءاً
ماشاء الله تبارك الرحمن عليك..شرح وافي فى crystal systems and minerals
ننتظر المزيد من شخصك الكريم....
حور
أرسل بواسطة: geologe في فبراير 19, 2007, 09:09:47 مساءاً
وفي أمان الله